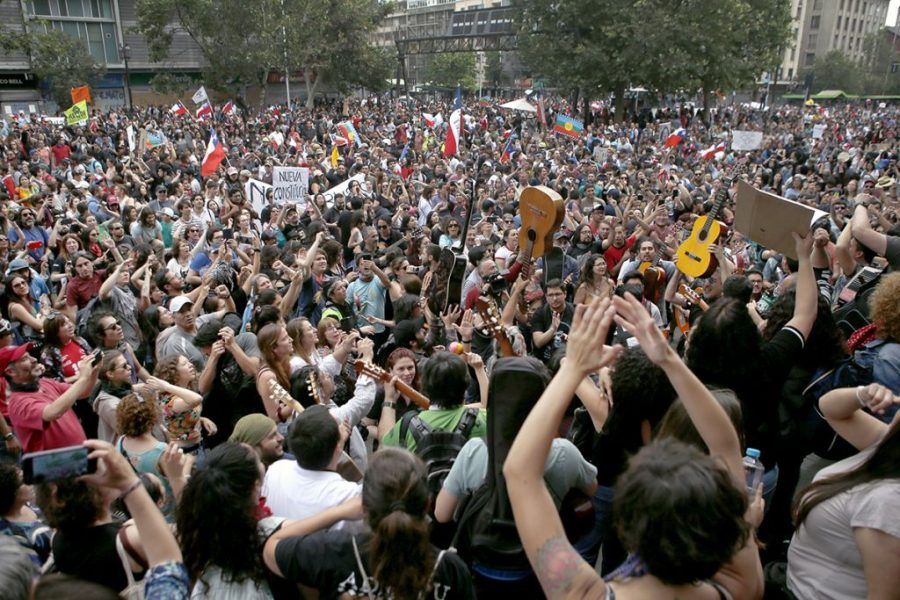El anuncio del primer borrador del genoma humano el año 2000 fue presentado como una revolución total en la ciencia. El mapa genético entregaría la clave para el diagnóstico, la prevención y el tratamiento de la mayoría, si no de todas, las enfermedades humanas. Poco más de una década más tarde, la técnica de edición de ADN, CRISPR/Cas9, anotaba otro golpe a favor de la ciencia y hacía realidad lo que parecía imposible: modificar las instrucciones genéticas de la vida. En los últimos días, el mundo científico sufrió otro remezón tras el anuncio del investigador chino, He Jiankui, quien aseguró haber modificado genéticamente a dos gemelas, quienes habrían nacido inmunes a diversas enfermedades, entre ellas al VIH. La crítica de sus pares no tardó en llegar, abriendo un debate ético que hoy se hace inevitable: nuestra transformación, y eventualmente, la de nuestra descendencia.
Por Francisca Siebert | Ilustraciones David S. Goodsell, Scripps Research Institute
“La ciencia genómica tendrá un impacto auténtico en nuestras vidas y, más aún, en las vidas de nuestros descendientes. Revolucionará el diagnóstico, la prevención y el tratamiento de la mayoría, si no todas, las enfermedades humanas”, dijo Bill Clinton, presidente de los Estados Unidos, el 26 de junio del año 2000 al anunciar en la Casa Blanca, junto al primer ministro de Gran Bretaña Tony Blair, que el mundo ya disponía del primer borrador del genoma humano.
Miles de millones de dólares y años de trabajo de una empresa que unió a un consorcio de países desarrollados y al mundo privado costó la secuenciación de las 3 mil millones de bases del genoma humano, aquella trama de texto cuyo abecedario nos constituye como seres vivos. Hoy, a 18 años de ese hito, la técnica avanzó lo suficiente como para permitirnos acceder masivamente a esa información. Clonación, uso de células madre, secuenciación y edición genómica. El destino biológico de los organismos vivos, y particularmente de los seres humanos, parece estar hoy –casi- en nuestras manos.
“Los costos de secuenciar el genoma están bajando estrepitosamente, al punto de que al día de hoy se puede tener un genoma razonable por unos 1000 dólares. Con eso, uno puede hacer un diagnóstico detallado de muchas enfermedades y características de un individuo. Creo que eventualmente vamos a estar todos enfrentados a la decisión de secuenciarnos o no”, advierte Miguel Allende, director Centro de Regulación del Genoma, para quien esta posibilidad es uno de los dos elementos que están generando una revolución en el área de genética y genómica.
Mientras el primer genoma humano secuenciado se obtuvo a partir de varios individuos, diversos proyectos científicos alrededor del mundo han secuenciado el ADN de millones de hombres y mujeres de diversas edades, etnias y condiciones físicas, y conforme el procedimiento pasó a ser parte de un servicio de mercado, cuyo valor además se vuelve cada día más accesible, su realización por motivos médicos o personales se multiplica.
No obstante, por mucho que la ciencia haya podido acceder al código, la secuenciación del ADN no describe lo que el organismo o el individuo es, sino su potencial genético, es decir, sus posibilidades y limitaciones.
“Podemos secuenciar nuestro genoma, podemos detectar diferencias entre nuestra secuencia y la “normal” que sean relevantes para nuestra salud y, secuenciando a nuestros familiares, reconocer aquellas mutaciones heredadas versus las que aparecieron por primera vez en nosotros (mutaciones somáticas). El ADN es la molécula de la herencia, pero no de la esencia ni de la trascendencia”, apunta Miguel Allende en el libro La lógica de los genomas.
Así, por ejemplo, se ha llegado a detectar que las mujeres con una mutación en el gen BRCA1 tienen un 55 por ciento de probabilidad de manifestar un cáncer de mama, versus el 12 por ciento de probabilidades que tienen aquellas que no cuentan con la mutación. La mutación en este caso abre una pista relevante para la medicina, sin embargo, la interacción celular y entre genes, la suma de mutaciones, los factores ambientales y la historia de cada persona intervienen en el desarrollo o no de la enfermedad.
Medicina a tu medida
Mónica Acuña, magíster en Bioestadística, profesora de la Facultad de Medicina e integrante del Instituto de Ciencias Biomédicas, es fundadora de Genytec, el primer laboratorio privado en realizar test de ADN en el país, hace ya más de 20 años. Además, es el único que actualmente ofrece en Chile los servicios de farmacogénetica, disciplina que estudia las variaciones genéticas responsables de la respuesta a fármacos, y farmacogénomica, la cual realiza estas indagaciones con herramientas todavía más sofisticadas.
“Yo genotipifico al paciente para uno o más genes, directamente utilizando ADN, y le puedo decir al médico que de acuerdo a su genotipo el paciente es metabolizador lento, rápido o ultra rápido del fármaco. O bien le puedo decir que el individuo es resistente o sensible al fármaco”, dice la Dra. Acuña, quien realiza diversos tipos análisis genéticos con el fin de orientar a los médicos respecto a las estrategias terapéuticas a seguir.
“Esto es lo que se llama medicina personalizada”, señala la investigadora, quien comenta que esta indagación requiere realizarse sólo una sola vez en la vida y tiene un costo que por lo bajo va entre 300 mil y 500 mil pesos. La secuenciación de todo el ADN de los pacientes no es necesaria para la medicina personalizada a no ser que la complejidad del caso lo amerite.
Los test genéticos, que son extendidamente usados en países como Estados Unidos, Brasil y buena parte de los europeos, también son utilizados por pacientes que tienen familiares con patologías que pueden prevenirse, como es el caso del cáncer de mama, o por aquellos que, teniendo una patología, quieren conocer su variante para adecuar sus tratamientos y obtener más información sobre las perspectivas de la enfermedad.
“No todos los Parkinson son iguales, ni todos los cánceres, aunque sea el mismo tipo genético. De acuerdo a la variante que presente el cáncer puede ser más o menos agresivo. La esperanza de vida también cambia para una variante y para otra, y eso también se necesita saber. Todo eso ya es información que se le puede entregar al paciente”, dice la Dra. Acuña.
Pese a la amplia gama de posibilidades que hoy entrega la farmogenética, la investigadora del ICBM sigue manteniendo la cautela respecto a lo que esta disciplina puede ofrecernos: “La genética no se conoce a cabalidad, sabemos que hay genes involucrados en ciertas patologías, pero no se conoce la totalidad, sobre todo en las llamadas enfermedades complejas”.
No obstante esta dosis de realidad, la académica está cierta de que conociendo y sabiendo más cada día, va a ser posible aumentar la prevención, entregar más terapias y generar fármacos más baratos a través de la ingeniería genética. “Eso es lo que se pretende y para los Estados es súper importante porque la prevención reduce los costos. La cantidad de dinero que se necesita hoy es tremenda, la genética va a resolver el problema del financiamiento de la salud de aquí a unos años más, previniendo las enfermedades”, concluye.
CRISPR: la revolución del copiar y pegar
Tras la secuenciación del ADN humano en 2003, las cartas estaban echadas: el próximo paso era lograr la manipulación del genoma, cuestión que tardó algunos años en llegar y que finalmente lo hizo en 2012 de la mano de dos mujeres: Jennifer Doudna y Emmanuelle Charpentier.
“Una grieta en la creación”, así calificó la bioquímica Doudna de la Universidad de California, a CRISPR/Cas9, una técnica de edición de ADN que permite alterar la secuencia, modificando las instrucciones genéticas de la vida.
CRISPR, detalla Miguel Allende, es una técnica que, a través de herramientas moleculares, permite entrar en el genoma y realizar cambios bastante precisos y casi a voluntad en éste. “Eso significa que podríamos llegar a hacer correcciones o reparar enfermedades, o generar genes que estén funcionando mejor en los casos patológicos. El más claro es el cáncer, pero también hay muchas enfermedades degenerativas, todas de origen genético, que uno podría tratar de curar con bastante más precisión que antes”, afirma Allende.
Jimena Sierralta, Profesora Titular de la Facultad de Medicina de la U. de Chile y subdirectora del Departamento de Neurociencias, es una de las científicas que desde hace algún tiempo trabaja con CRISPR en Chile, específicamente en un tipo de mosca drosófila.
“CRISPR es una técnica que tiene, desde el punto de vista teórico, una potencialidad inmensa. Dependiendo de qué tipo de células se repare, permitiría reparar a la persona, o también eventualmente a su descendencia”, apunta Sierralta, quien estima que a futuro se esperaría poder revertir una mutación en las células germinales del padre o de la madre, y lograr así que sus hijos no las porten.
“Las tijeras genéticas”, como popularmente se conoce a CRISPR, es una técnica que también podría utilizarse en algunos cánceres que son muy intratables, como los astroliomas u otros cerebrales. Según Sierralta podría eventualmente intentarse, a través de inyecciones localizadas, una estrategia que matara ese tumor por medio de la deleción (procedimiento que se asemeja a borrar un trozo del ADN) de algún gen esencial del mismo. “Eso no se ve tan lejano porque ha habido un gran desarrollo de virus que se van específicamente a algunas células y no infectan todo sino que trabajan de manera muy localizada en el lugar donde uno los inyecta solamente”, afirma la académica.
Pese a la amplia gama de alternativas que son posibles de imaginar utilizando CRISPR, la complejidad que plantea el genoma y sus interacciones vuelve a levantarse como el gran desafío que tiene esta técnica para seguir adelante. “Tú cambias un gen, pero la respuesta del humano completo es la interacción entre los genes, no es el gen en particular. Es muy difícil además hacer el CRISPR para muchos genes a la vez. Todavía no sé de alguien que haya logrado hacer un CRISPR ni siquiera para dos genes a la vez. Entonces, cambiar muchos genes a la vez en un ser humano, no es posible pensarlo todavía”, asegura Sierralta.
Las dificultades, sin embargo, están lejos de detener el camino emprendido en el ámbito de la edición genómica. La técnica, estima la subdirectora del Departamento de Neurociencias, seguirá mejorando y especificándose con el tiempo, y de tener éxito, podría cambiar radicalmente mucho de lo que hoy damos por sentado.
Nuevos y mejores humanos
Dado que existe la posibilidad de modificar un gen que está defectuoso, también entonces es momento de pensar en la posibilidad de modificar un gen que no necesariamente lo está.
Aumentar nuestra potencia muscular, mejorar nuestra memoria, combatir obesidad, la calvicie, la intolerancia a ciertos alimentos o producir anticuerpos sin la necesidad de vacunar son algunas modificaciones que podríamos realizar por medio de la edición genética.
Y aunque por el momento la manipulación genética de manera heredable está prohibida en la gran mayoría de los países, tanto en China como en Estados Unidos ya se ha intervenido el genoma de embriones humanos, demostrando que su manipulación es perfectamente posible. Aunque la decisión en ambos países fue no llevar dichos embriones a término, el duelo biomédico entre ambas potencias avanza y el debate ético que esto supone no tardará en permear a la sociedad civil.
“Habrá una inmensa presión sobre los científicos y tecnólogos para las aplicaciones menos cuestionables éticamente y sobre las cuales probablemente haya también menos restricciones regulatorias, al ser materia de opción personal. Le doy unos 20 años al desarrollo de acceso masivo a estas opciones”, sentencia en su libro Miguel Allende, al tiempo en que llama a sumarnos desde ya a un debate que nos involucra a todos.